Níveis de energia no átomo de Bohr
Este material é parte integrante do Jogo do Prêmio Nobel de Atomística
© Carlos Alberto dos Santos, Eliabe Maxsuel de Aquino, Farnésio Vieira Diniz
© Carlos Alberto dos Santos, Eliabe Maxsuel de Aquino, Farnésio Vieira Diniz
Na página anterior, levantei as seguintes questões:
- A que distância do núcleo gira o elétron?
- Ele pode girar a qualquer distância do núcleo?
- Uma vez girando em determinada órbita, o elétron ficará para sempre nessa órbita?
- O que acontecerá se o elétron pular de uma órbita para outra?
Nessa página e na seguinte vamos responder essas questões.
A que distância do núcleo o elétron gira?
Nos seus postulados, Bohr afirma que os elétrons só podem girar em determinadas órbitas. Não é em qualquer órbita que ele pode girar. Nessas órbitas, também denominadas níveis ou estados, o elétron pode ficar indefinidamente sem emitir qualquer radiação eletromagnética. É por isso que ele denominou essas órbitas ou níveis ou estados, de órbitas estacionárias, níveis estacionários ou estados estacionárias.
Bohr utilizou outros postulados que permitem calcular as distâncias em que o elétron pode girar em torno do núcleo. Ele aplicou para o caso do átomo de hidrogênio e obteve resultados que foram comprovados experimentalmente. Vamos restringir aqui nossa discussão ao caso do hidrogênio porque para outros átomos os conceitos de matemática e de física necessários não estão ao alcance dos alunos do ensino médio.
Uma coisa precisa ser dita imediatamente, cada órbita estacionária tem um raio e uma energia característicos, que podem ser deduzidos a partir dos postulados de Bohr. No entanto, embora a matemática necessária para essas deduções seja simples, nem todos os alunos do ensino médio conhecem os conceitos de física envolvidos nessas deduções. Mesmo assim, podemos discutir os resultados finais dessas deduções.
Além disso, o que é importante para o nosso estudo aqui não é o raio da órbita, mas a energia do elétron em cada órbita. É o que veremos mais adiante.
O elétron fica para sempre na órbita estacionária?
Não! Se a órbita for a mais interna, ou seja a mais próxima do núcleo, ele poderá sair de lá se receber energia externa. Existem alguns tipos de energia que ele pode receber, mas vamos aqui discutir apenas as energias de origem eletromagnética.
Que energias são essas?
São energias fornecidas por um feixe de luz visível, luz ultravioleta, infravermelho ou raios-X. Quando uma radiação dessa atinge o elétron, ele salta para uma órbita mais externa, dependendo do valor da energia. Este valor tem que ser exatamente um que possibilite a passagem para um nível mais externo. Nem mais nem menos. Vamos detalhar isso mais adiante.
E se a órbita em que se encontra o elétron não for a mais interna?
No caso do átomo de hidrogênio, o elétron pode ocupar qualquer órbita mais externa, desde que receba energia necessária para o salto ou transição. Pouco tempo depois que chega à órbita externa, o elétron pula para algum nível inferior, emitindo uma radiação. O tempo que ele fica em qualquer órbita acima da primeira órbita estacionária é de aproximadamente 10 nanossegundos. O nanossegundo é a bilionésima parte do segundo.
O salto de volta pode ser diretamente para o nível original, ou para algum nível entre o original e o final.
Sempre que entre o nível original e o final houver outros níveis, o elétron pode chegar ao nível inicial por etapas, saltando de um nível a outro.
É assim que surgem as séries espectrais, nosso tema da próxima página.
| Precisamente, quais são as energias envolvidas nas transições? As
figuras à direita ilustram o que acabei de escrever para o átomo de
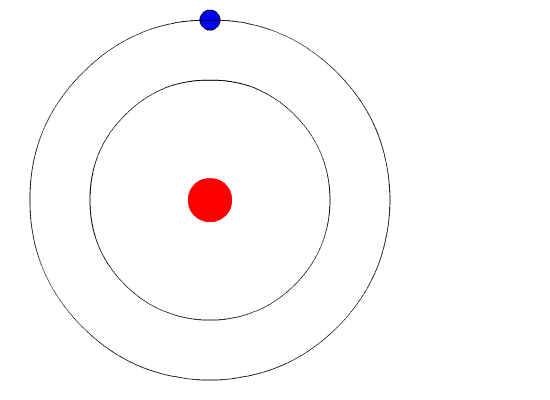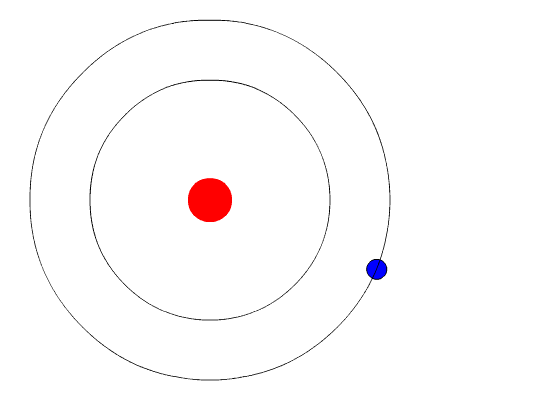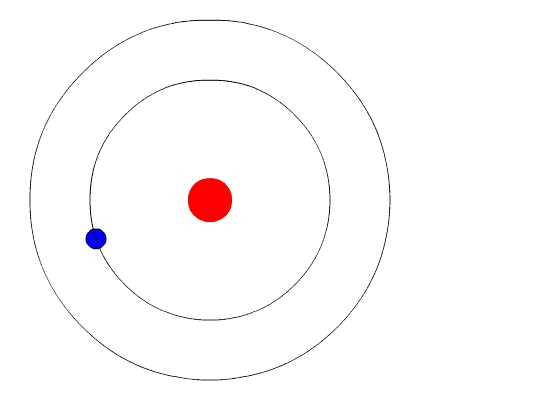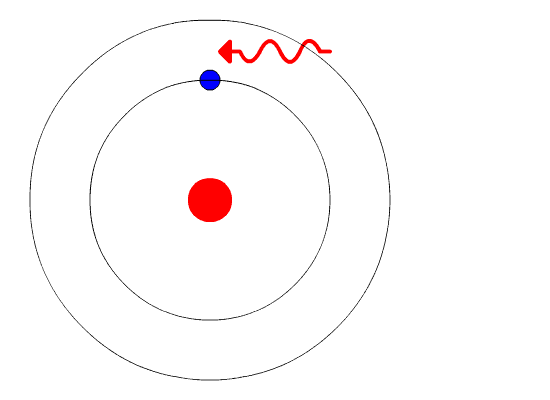
hidrogênio. Na figura de cima vemos apenas os dois primeiros níveis.
Quando uma radiação eletromagnética interage com o elétron no nível
inferior, ele pula para o superior. Logo depois ele volta ao nível
inferior.
Na figura do meio, são exibidos diversos níveis, com números que serão explicados na página seguinte. A figura inferior é igual à do meio, apenas desenhada de outra forma. Em vez de representar a distância ao núcleo, como na figura do meio, a figura inferior representa os níveis em termos de energia, que é o assunto que vamos tratar agora. A
cada um desses níveis, 1, 2, 3, etc, está associada uma energia. Isto
significa que um elétron nesses níveis terá a energia correspondente. A
dedução dessa energia é simples, mas nem todos os alunos do ensino
médio dominam os conceitos de física necessários. Então, vou escrever a
fórmula da energia associada a um nível qualquer, n, e explicar o que
ela representa.
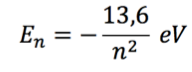
|
 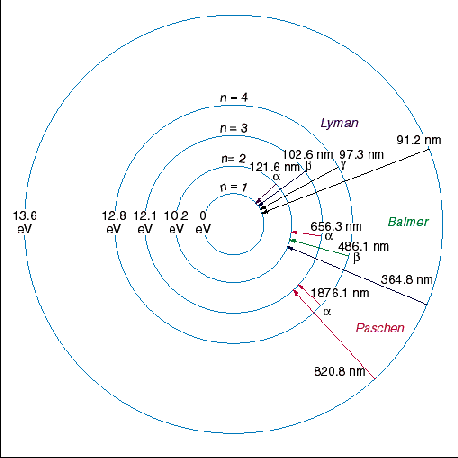 Desenhando extraído de http://astro.if.ufrgs.br/rad/espec/espec.htm 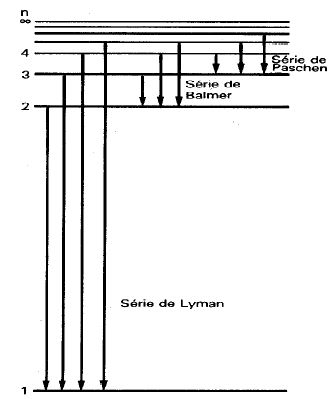 |