Séries espectrais do átomo de hidrogênio
Este material é parte integrante do Jogo do Prêmio Nobel de Atomística
© Carlos Alberto dos Santos, Eliabe Maxsuel de Aquino, Farnésio Vieira Diniz
© Carlos Alberto dos Santos, Eliabe Maxsuel de Aquino, Farnésio Vieira Diniz
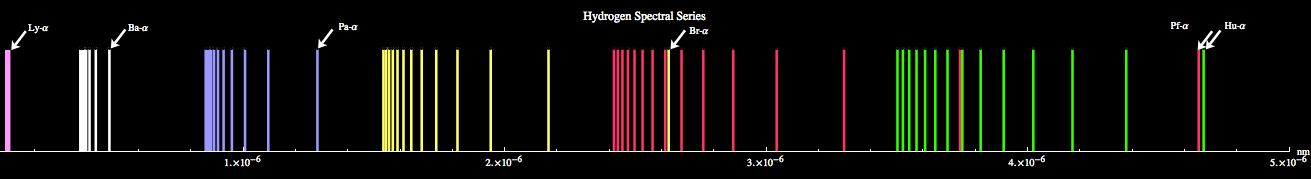
 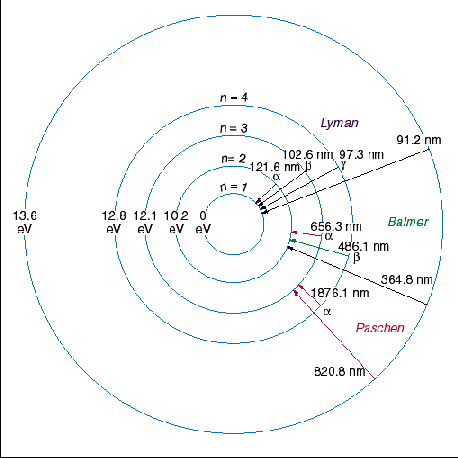 Desenhando extraído de http://astro.if.ufrgs.br/rad/espec/espec.htm Essa figura apresenta as mesmas informações da figura superior. Primeira linha da série de Lyman A
série de Lyman é o conjunto de transições para o nível fundamental do
átomo de hidrogênio. Se o elétron saltar de qualquer nível, diretamente
para o nível fundamental ele emite uma radiação pertencente à série de
Lyman. Para saber qual o tipo
de radiação é necessário calcular sua frequência.
Como é que se calcula a frequência e o comprimento de onda de uma radiação eletromagnética? Para
exemplificar, vamos calcular apenas a primeira linha dessa série, ou
seja a radiação emitida quando o elétron salta do nível 2 para o nível
1. Como exercício, você deve calcular todas as linhas exibidas na
figura acima.
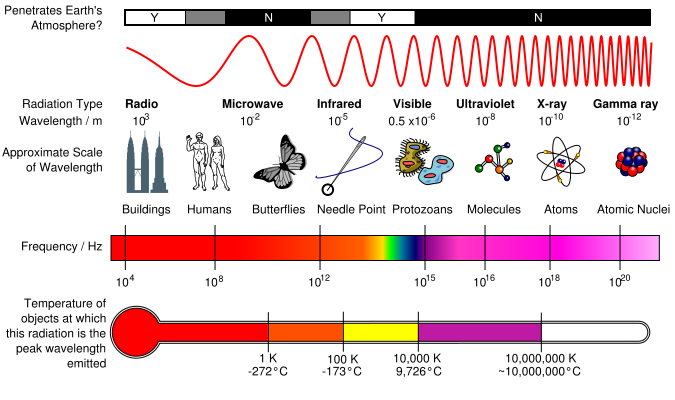
Pelo postulado de Bohr, a energia liberada é dada pela fórmula 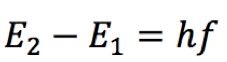 Substituindo n=2 na fórmula da série de Lyman (veja na coluna à direita), teremos 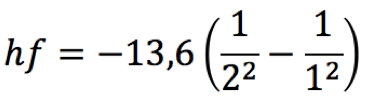 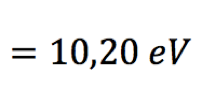 Usando o valor de h em eV.s, 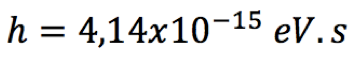 obtém-se o valor da frequência 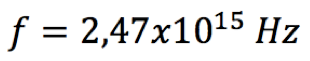 Usando a relação entre comprimento de onda e frequência, para o caso da luz 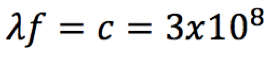 Obtém-se o valor do comprimento de onda 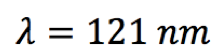 A radiação que tem esses valores de frequência e comprimento de onda encontra-se na faixa do ultravioleta. Observe atentamente o espectro eletromangético na figura ao lado. |
Provavelmente você já viu essas figuras à esquerda na página sobre os níveis de energia
no átomo de hidrogênio. Vamos considerá-las agora para explicar as
séries espectrais do átomo de hidrogênio. Essas séries apresentadas na
figura abaixo do título da página, foram
originalmente observadas pelos pesquisadores Theodore Lyman
(1874-1954), Johann Balmer (1825-1898) e Friedrich Paschen (1865-1947),
vários anos antes do modelo de Bohr. Existem outras séries, mas vamos ficar aqui apenas com essas três.
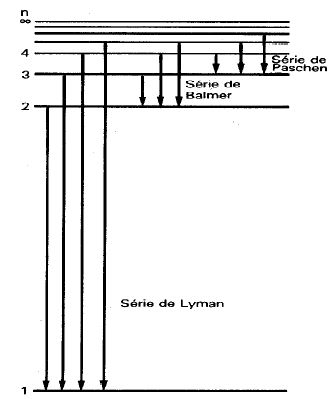
Existem várias maneiras de se observar essas séries. Uma maneira simples de observá-las é fazer passar um feixe de luz ultravioleta através de um recipiente contento hidrogênio. Logo depois os átomos de hidrogênio emitem diversas radiações, que vão do infravermelho ao ultravioleta. Com um sensor de luz podemos observar essas radiações, como ilustrado na figura abaixo do título da página. A obtenção de suas expressões matemáticas foi um dos primeiros sucessos de Bohr. A partir do modelo de Bohr podemos entender como elas surgem. Observe bem a figura superior ao lado. O que acontecerá com um elétron colocado no quinto nível? Não importa a forma como ele chegou a esse nível. Ele pode ter chegado de algum nível inferior, recebendo energia eletromagnética suficiente para a transição, ou pode ter vindo de um nível superior, depois de emitir a correspondente radiação. O que importa aqui é que ele está no quinto nível. Aproximadamente 10 nanossegundos depois que ele chega ao quinto nível ele salta para algum nível inferior por meio de uma das seguintes possibilidades, entre outras que você pode descobrir examinando atentamente a figura:
Cada transição dessa resulta numa linha espectral. Ou seja, quando o elétron salta para um nível mais interno, ele emite alguma radiação eletromagnética, que pode ser luz visível, infravermelho ou ultravioleta. No caso de átomos pesados, como ferro, cobalto, cobre, etc, as transições geralmente resultam na emissão de raios-X. As transições exibidas na figura acima, são matematicamente descritas por uma dessas equações: 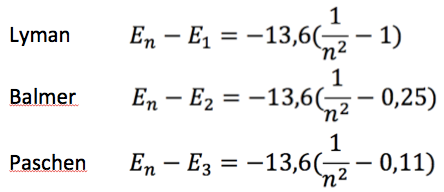 Pela
aparência das fórmulas, percebe-se que a matemática envolvida é muito
simples. Então, vamos realizar alguns cálculos com essas fórmulas.
 Repita
os cálculos apresentados ao lado, para as séries de Balmer e Paschen, e
mostre que elas pertencem, respectivamente, às faixas do visível e do
infravermelho.
|
O que você vai querer?