Propriedades do núcleo e reações nucleares
Este material é parte integrante do Jogo do Prêmio Nobel de Atomística
© Carlos Alberto dos Santos, Eliabe Maxsuel de Aquino, Farnésio Vieira Diniz
© Carlos Alberto dos Santos, Eliabe Maxsuel de Aquino, Farnésio Vieira Diniz
| Na página sobre a descoberta da radioatividade, vimos que Marie e Pierre Curie descobriram que a radioatividade era um fenômeno novo, diferente de tudo que era conhecido até então. Era um fenômeno espontâneo e típico de alguns elementos, que eles denominaram elementos radioativos. Essas descobertas deram origem à importante área da física, denominada FÍSICA NUCLEAR, cujos fundamentos serão tratados nessa página. |
ALGUMAS PROPRIEDADES DO NÚCLEO
| Por que urânio, tório, polônio, rádio
e tantos outros elementos químicos apresentam as propriedades que
classificamos como radioativas, ou dito de outro modo, por que esses
elementos são radioativos, ou dito ainda de outro modo, por que existe
a radioatividade? Aí está uma pergunta super importante e necessária para o avanço do conhecimento da física. Mas, infelizmente não podemos respondê-la integralmente aqui. Para isso teríamos que dominar bem a física quântica, ou mecânica quântica, como os físicos preferem denominar essa área do conhecimento. Todavia, não precisamos ficar triste, pois alguns aspectos dessa teoria podem ser abordados aqui. Para os cientistas, o modelo atômico de Rutherford-Bohr é muito simples para ser usado nas situações reais, mas no nível do ensino médio esse modelo é muito bom. Além disso, ele funciona bem em casos reais com o átomo de hidrogênio. De acordo com esse modelo, o átomo é constituído de um núcleo, em torno do qual giram os elétrons. |
 Átomo de hidrogênio no modelo de Rutherford-Bohr  Os quarks do nêutron |
No caso do átomo de hidrogênio, o núcleo contém um próton, que é quase duas mil vezes mais pesado que o elétron. Todos os átomos, excetuando o hidrogênio, têm em seus núcleos, duas partículas de massas similares, uma com carga positiva, o próton, e outra sem carga, o nêutron. Até os anos 1930, todos acreditavam que prótons, nêutrons e elétrons eram partículas elementares. Ou seja, não eram constituídas por outras partículas. Mas o avanço da física quântica deu origem à física de partículas elementares e ficou provado que dessas três partículas, apenas o elétron é elementar. Foram descobertas várias partículas elementares, e propostos os quarks como partículas existentes no interior de prótons e nêutrons. |
| Esse assunto não pertence à radioatividade, e por isso não será abordado aqui, mas é importante ter em mente que nem o próton, nem o nêutron são partículas elementares. Cada um deles é constituído de três quarks, como ilustra a figura acima para o caso do nêutron. |
| Agora
voltemos ao núcleo tendo em mente apenas que ele é constituído de
prótons e nêutrons. Não importa, para o que vamos discutir, que prótons
e nêutrons sejam formados por quarks. Em primeiro lugar, os elétrons orbitam em torno do núcleo por causa da atração elétrica entre a carga positiva do próton e a negativa do elétron. Não precisamos discutir essa questão aqui. Ela é discutida no âmbito do modelo de Rutherford e Bohr. A primeira questão importante em se tratando do fenômeno da radioatividade é: o que aconteceria com o núcleo se ele fosse formado unicamente de prótons? |
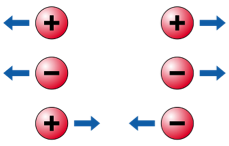 |
Como os prótons possuem carga elétrica positiva, a tendência é que haja repulsão entre eles. Como você sabe, cargas elétricas de mesmo sinal se repelem, e cargas elétricas de sinais contrários se atraem. |
| Então,
o átomo de hélio, que tem dois prótons no núcleo, e dois elétrons
orbitando em volta do núcleo, não poderia existir se não fossem os dois
nêutrons que existem ao lado dos prótons. Ou seja, a existência do
átomo de hélio deve-se aos nêutrons, que de algum modo seguram os
prótons. Dito de outra forma, os dois nêutrons se opõe à força de
repulsão elétrica entre os prótons. Mas, como isso acontece? |
| Bom, mais uma vez devo dizer que a explicação detalhada não é tão simples. Podemos dizer que os nêutrons seguram os prótons no interior do núcleo por causa das forças nucleares. Então, além das forças gravitacionais e das forças eletromagnéticas que você já viu no seu curso de física, acabamos de incluir uma nova força. | 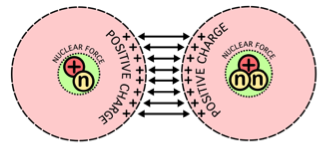 https://commons.wikimedia.org/wiki/File:Nuclear_ fusion_forces_diagram.svg?uselang=pt-br |
| Ao contrário das forças eletromagnéticas, que podem ser atrativas ou repulsivas, as forças gravitacionais e nucleares são atrativas.
Na verdade existem duas forças nucleares, a fraca e a forte, mas apenas
a forte tem a ver com a estabilidade nuclear. Ou seja, é a força nuclear forte que mantém prótons e nêutrons no interior do núcleo, como ilustra a figura acima. Vamos analisar essa situação mesmo sem conhecer a teoria da física nuclear. No caso do átomo de hélio, cujo núcleo possui dois prótons, são necessários dois nêutrons para evitar que esses prótons se repilam. Para continuar discutindo essa questão, é melhor passarmos a usar a notação que os cientistas usam.
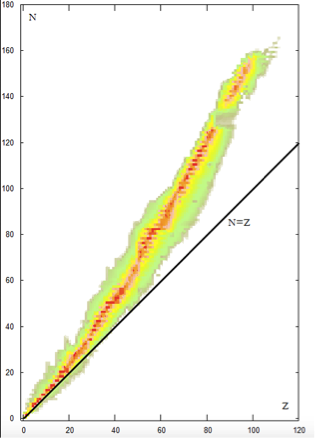
O número de prótons de um átomo, que é igual ao número de elétrons, é denominado número atômico e é representado pela letra Z. A soma do número de prótons e de nêutrons é o número de massa, representado pela letra A. Quando queremos mencionar prótons ou nêutrons, como partículas no interior do núcleo, sem destacar um ou outro, costumamos denomina-los nucleons. Então, o núcleo do hélio tem 4 nucleons. Costuma-se também chamar o núcleo de nuclídeo. Na tabela abaixo são colocados os números atômicos, números de massa e números de nêutrons, N, de dez elementos químicos. Cinco com Z menor que 10 e cinco com Z maior que 20. Os cinco primeiros são considerados átomos leves, e os outros são átomos pesados. Que conclusões podemos tirar dessa tabela? |
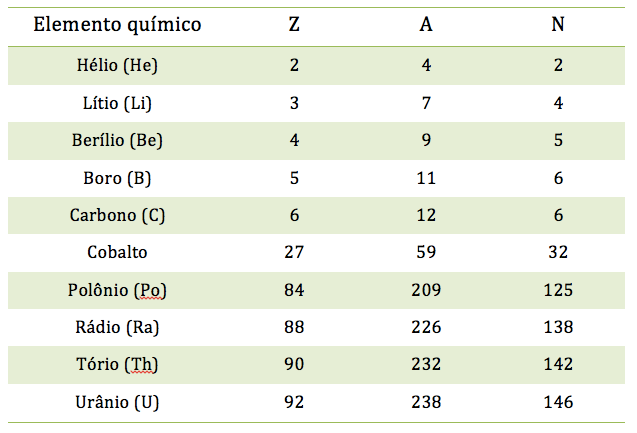
| Uma
conclusão evidente é que em nenhum caso o número de nêutrons é menor do
que o de prótons. Isso vale para todos os elementos químicos. Ou seja,
o número de nêutrons é sempre igual ou maior que o de prótons.
E são raros os casos em que Z=N. Outra conclusão é que para os
elementos leves, o número de nêutrons é muito próximo do número de
prótons, enquanto para os elementos pesados N é muito maior do que Z. Isso pode ser visto na figura ao lado. Veja que depois de Z=20, a região colorida começa a ficar acima da reta para a qual N=Z. Mais adiante você vai entender porque a região colorida não é uma reta. Por que o número de nêutrons é muito maior do que o de prótons nos elementos pesados? |
 https://upload.wikimedia.org/wikipedia/commons /7/7a/Isotopes_and_half-life.PNG |
 http://physicsnet.co.uk/a-level-physics-as-a2/ radioactivity/nuclear-radius/ |
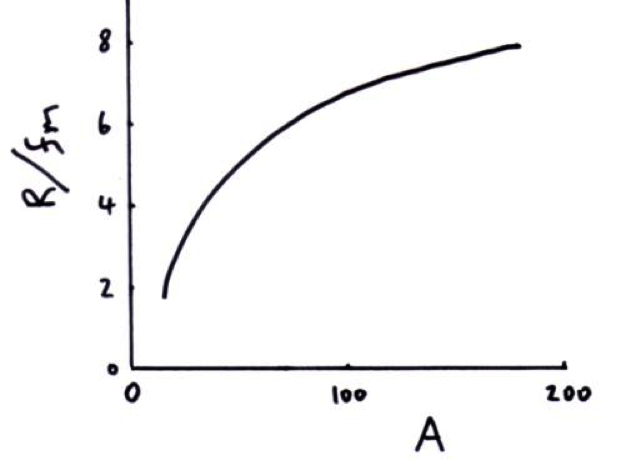
Uma explicação simples para o aumento do número de nêutrons nos átomos pesados, é que o volume do núcleo cresce menos do que o número prótons e nêutrons e tende para um valor constante, como sugere a figura ao lado. Então com o crescimento do número de nucleons o núcleo vai ficando mais denso, os prótons vão ficando cada vez mais próximos uns dos outros, o que aumenta a força de repulsão elétrica. Portanto, é necessário cada vez mais nêutrons para manter tudo isso dentro do volume nuclear. |
| O problema é que isso faz com que o núcleo seja um ambiente de muita energia, e a natureza não gosta de ambientes muito energéticos. A tendência na natureza é produzir reações para reduzir a energia. A natureza gosta de caminhar na direção de menor energia. São os processos nucleares para liberar energia que resultam nos fenômenos englobados pela radioatividade. Isso será tratado logo em seguida, mas antes devemos tomar conhecimento de uma classificação dos nuclídeos em termos das quantidades de prótons e nêutrons. |
| ISÓTOPOS, ISÓBAROS E ISÓTONOS |
| Sabe porque tem aquela faixa colorida na figura que contém o número de nêutrons (N) em função do número atômico (Z)? É porque praticamente todos os elementos químicos têm nuclídeos com diferentes quantidades de nêutrons. Então, para cada valor de Z aparecem vários pontos, com diferentes valores de N, e portanto com diferentes valores de número de massa. |
| Um nuclídeo X, com número atômico Z e número de massa A é representado por um desses símbolos | 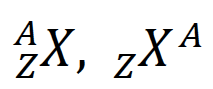 |
| Isótopos: Nuclídeos com mesmo Z e diferentes valores de N. Essa é a principal classe de nuclídeos. |
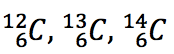 |
| Isóbaros:
Nuclídeos com mesmo número de massa, A, e diferentes valores de Z e de
N. Essa é uma classe que tem pouco importância na física nuclear. |
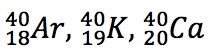 |
| Isótonos: Nuclídeos com mesmo valor de N e diferentes valores de Z e de A. Essa classe é ainda menos importante do que a dos isóbaros. |
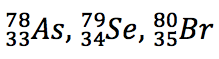 |
| RADIAÇÕES NUCLEARES ALFA, BETA E GAMA |
| À medida que a natureza cria átomos com número crescente de elétrons e prótons, ela precisa colocar nêutrons
no interior do núcleo para evitar a repulsão dos prótons. Mas esse
processo gera muita energia, que podemos denominar genericamente de energia nuclear. Então, espontaneamente o núcleo liberar energia sob a forma de alguma radiação. Esse é o processo que denominamos radioatividade. Os cientistas costumam denominar decaimento radioativo o processo pelo qual o núcleo libera energia. Essa liberação se dá por meio de uma emissão radioativa. O resultado da emissão também é conhecido como radiação nuclear. Com alguma frequência esses termos são usados indistintamente. Tanto Becquerel, quanto o casal Pierre e Marie Curie estudaram as emissões radioativas sem saber do que se tratavam. Becquerel as estudava pelo escurecimento que produziam em chapas fotográficas. Marie e Pierre Curie estudavam a capacidade que essas radiações tinham de ionizar o ar. Um ano após os primeiros experimentos do casal Curie, ou seja, no início de 1899, Ernst Rutherford notou a existência de dois tipos de radiação, uma menos penetrante, que ele chamou de radiação alfa e outra mais penetrante que ele chamou de radiação beta. A partir de então outros pesquisadores passaram a estudar essas radiações separadamente. A separação era feita com campos elétricos e magnéticos. Não necessitamos aqui entrar nos detalhes técnicos. É suficiente saber que um campo magnético podia desviar essas radiações, uma para um lado, e outra para o outro lado. E havia algumas radiações que não eram desviadas por um campo magnético. Em 1900, o físico e químico francês Paul Ulrich Villard, pouco conhecido na história da ciência, descobriu que as radiações que não se desviavam eram de dois tipos. Um deles era a conhecida radiação alfa. O outro tipo, muito mais penetrante, foi denominado raios gama. Na verdade, os raios alfa podem ser desviados por um campo magnético, mas como sua massa é muito grande, o campo deve ser mais intenso do que aqueles usados no início dos estudos. Foi só em 1903, que Rutherford percebeu que a radiação alfa podia ser defletida elétrica e magneticamente, verificando então tratar-se de partículas com carga positiva. |
| Depois desses estudos ficou comprovado que: 1. Os raios alfa, ou radiações alfa são núcleos de hélio, com 2 prótons e 2 nêutrons.
2. Os raios beta são elétrons.
3. Os raios gama são radiações eletromagnéticas, similares aos raios-X, mas com maior poder de penetração.
|
| Vamos agora tratar essas radiações sob o ponto de vista de decaimento radioativo. Ou seja vamos ver o que acontece com o núcleo quando emite cada uma dessas radiações. A explicação que veremos aqui foi usada no início dos estudos desse fenômeno. A explicação atual exige profundo conhecimento da mecânica quântica. |
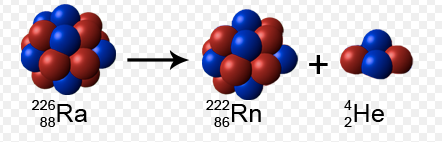 Um
dos isótopos do rádio, o rádio 226, ou Ra-226 contém 88 prótons e 138
nêutrons. Por meio do decaimento alfa este núcleo desaparece e surge um
isótopo de radônio, o Rn-222.
|
DECAIMENTO ALFA
O
núcleo tem prótons e nêutrons. Juntando 2 prótons e 2 nêutrons tem-se
uma partícula alfa. Se essa partícula alfa sair do núcleo, este ficará
com duas cargas positivas a menos. Ou seja, o valor de Z será diminuído
em duas unidades.
Portanto, após o decaimento resultará outro elemento com número atômico Z-2 e número de massa A-4. Existe uma equação para representar o fenômeno. Suponha que o núcleo original, também denominado núcleo-pai, seja designado pelo símbolo X, e que o núcleo resultante do decaimento, denominado núcleo-filho, seja designado pelo símbolo Y. Então, a equação que representa a transformação de X em Y por meio do decaimento alfa é: 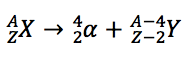 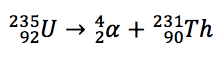 |
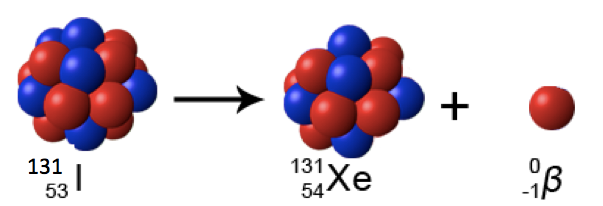 Um
dos isótopos do índio, o I-131, contém 53 prótons e 78 nêutrons. Por
meio do decaimento beta este núcleo desaparece e surge um isótopo de
xenônio, o Xe-131.
|
DECAIMENTO BETA O
decaimento beta é a emissão de um elétron pelo núcleo. Como é possível
a emissão de um elétron, se no interior do núcleo só tem prótons e
nêutrons?
Uma possibilidade é que um nêutron seja transformado em um próton e um elétron. Do ponto de vista do equilíbrio elétrico está tudo bem. Como a carga elétrica do próton é igual à carga elétrica do elétron, sendo uma positiva e outra negativa, a soma das duas resulta em carga nula. Então, próton + elétron = nêutron.
O problema é que nessa equação a energia está desbalanceada. Ou seja, não há conservação de energia. Talvez você queira saber como concluímos que não há conservação de energia nessa transformação. Não podemos discutir aqui essa questão, pois não dominamos os conceitos necessários. Basta sabermos que para que a energia seja conservada, ao lado do elétron, o núcleo libera uma partícula com massa praticamente nula, e que transporta a energia resultante da transformação do nêutron em próton. Essa partícula é denominada antineutrino do elétron. Então, a equação acima passa a ser próton + elétron = nêutron + antineutrino.
Na nomenclatura científica, a equação que descreve este decaimento é: 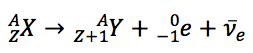 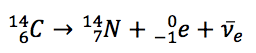
|
 |
DECAIMENTO GAMA
Nos dois processos
discutidos acima, o núcleo-filho é criado em um estado excitado, no
qual há um excesso de energia. Então imediatamente esse nuclídeo libera
energia sob a forma de uma radiação eletromagnética muito energética
conhecida como radiação gama, ou simplesmente raios gama. Esse processo
leva o núcleo para um estado de energia menor, como gosta a natureza. |