Diagrama de distribuição eletrônica
Este material é parte integrante do Jogo do Prêmio Nobel de Atomística
© Carlos Alberto dos Santos, Eliabe Maxsuel de Aquino, Farnésio Vieira Diniz
© Carlos Alberto dos Santos, Eliabe Maxsuel de Aquino, Farnésio Vieira Diniz
| Na página sobre as propriedades atômicas,
discutimos o preenchimento eletrônico das camadas de valência. Para
tanto tivemos que recordar o conceito de nível ou camada atômica (K, L,
M, N, etc) do modelo de Bohr. Tivemos também que introduzir os conceitos de termos espectroscópicos (s, p, d, f) e orbitais. Vamos agora aprender como distribuir os elétrons em todos os níveis eletrônicos. Costumamos denominar essa distribuicão como configuração eletrônica. |
Se
você ainda não leu as páginas mencionadas, você deve lê-las
imediatamente. Agora, se você já leu e quer apenas relembrar o
essencial, então aqui vai:
|
| O
chinês Pao-Fang Yi inventou um esquema simples para o prenchimento das
camadas eletrônicas. Não se sabe porquê, o esquema ficou conhecido como
diagrama de Pauling. Observe atentamente a figura ao lado, que é uma
das formas de apresentar o esquema. A primeira camada a ser preenchida
é a 1s. Depois vem na sequência: 2s-2p-3s-3p. |
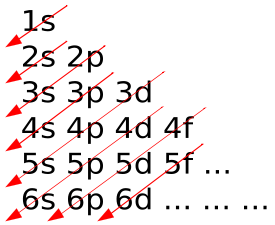 "Diagrama de Pauling"
|
| Depois
da 3p, o "esperado" seria preencher a 3d. Mas a natureza escolheu outro
caminho e começou a preencher a 4s. Quem explica isso é a mecânica
quântica, e a explicação tem a ver com a energia envolvida no
preenchimento das camadas eletrônicas. Ou seja o átomo fica em um
estado de menor energia (como gosta a natureza) quando coloca o elétron
na camada 4s, em vez de colocar na 3d. Então, a partir da 4s a sequência é assim: 4s-3d-4p-5s-4d-5p-6s-4f-5d-6p-5f-6d. Vamos agora determinar as configurações eletrônicas de alguns elementos. 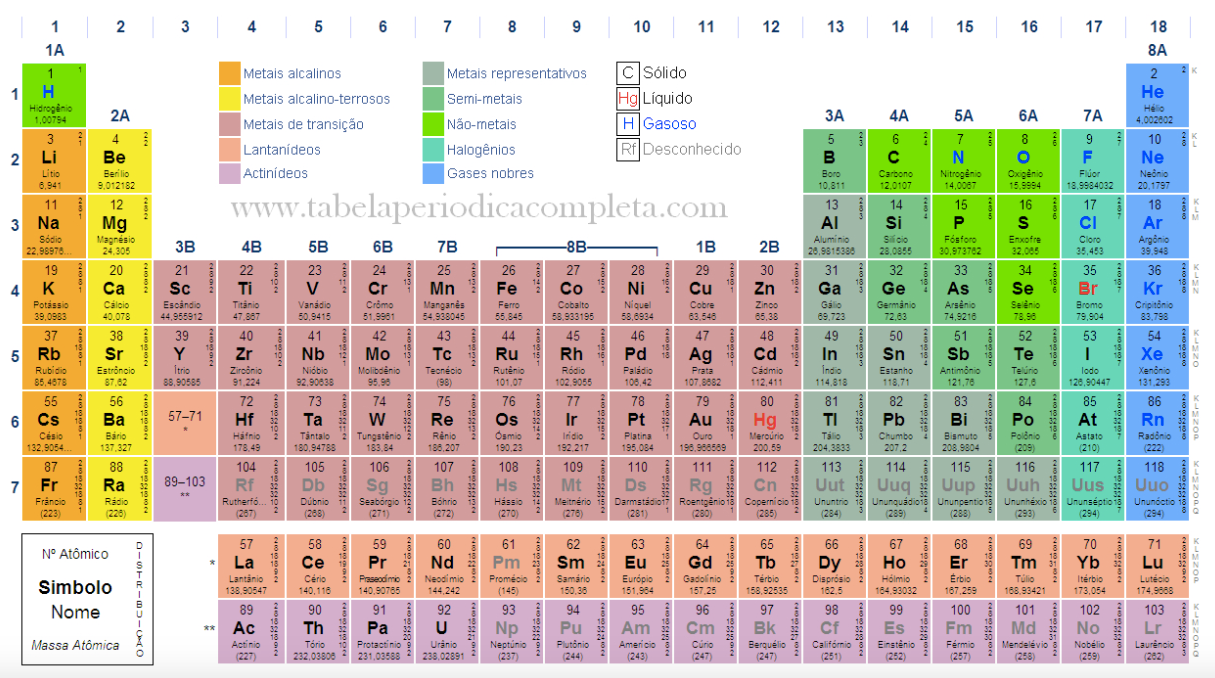 |
| Vamos considerar o último elemento do 3o. período, o argônio, Ar, que tem 18 elétrons, ou seja Z=18. De acordo com o diagrama de Pauling, sua configuração eletrônica é: 1s2-2s2-2p6-3s2-3p6. O primeiro elemento do 4o. período, o potássio, K, que tem 19 elétrons, ou seja Z=19, tem configuração eletrônica: 1s2-2s2-2p6-3s2-3p6-4s. Veja que essa configuração é igual à do Ar, acrescida de 4s.
Então, é mais simples representar a configuração eletrônica do potássio assim: [Ar]4s1. Veja que a configuração do potássio passa de 3p6 para 4s. Ou seja não preenche a 3d antes da 4s. É aqui que a "ordem natural" começa a ser alterada.
Mais adiante vamos ver elementos com Z entre 21 e 30. Preste atenção nesses elementos, o ENEM está cheio de questões a respeito deles. Mas, antes disso convém examinar o desenho abaixo.  Alguns
elementos estão organizados em blocos: s, p, d. Ainda tem o bloco f,
mas ele é muito complexo para o nosso nível de estudo. O Que significa
um elemento ser do bloco s ou do bloco p? Os elementos do bloco s são
aqueles que estão preenchendo os orbitais s. Os elementos do bloco p
estão preenchendo os orbitais p. O mesmo pode ser dito para os
elementos do bloco d, ou seja eles preenchem os orbitais d.
Observe a tabela periódica. O bloco d é composto pelos períodos 4, 5 e 6. Os elementos do período 4 são denominados elementos 3d, porque preenchem os orbitais 3d. Analogamente, tem-se os elementos 4d e 5d. Vamos ver como é mesmo essa história, começando pelo escândio, o primeiro elemento 3d, com Z=21. Pelo diagrama de Pauling, a configuração eletrônica será: [Ar]3d1-4s2, ou [Ar]3d4s2. Se você determinar as configurações eletrônicas dos elementos com Z=22 até Z=28, vai perceber que basta acrescentar sequencialmente 1 elétron na camada 3d. Ou seja a configuração do níquel, Z=28, será [Ar]3d8-4s2. Então, entre Z=22 e Z=28 o preenchimento segue o diagrama de Pauling.
ATENÇÃO: Algumas tabelas periódicas publicadas na internet apresentam as configurações desses elementos de transição (Z=29, 30, 47, 48, 79, 80), como se o diagrama de Pauling fosse válido. Por exemplo, essa tabela apresenta as configurações erradas. |