Propriedades atômicas
Este material é parte integrante do Jogo do Prêmio Nobel de Atomística
© Carlos Alberto dos Santos, Eliabe Maxsuel de Aquino, Farnésio Vieira Diniz
© Carlos Alberto dos Santos, Eliabe Maxsuel de Aquino, Farnésio Vieira Diniz
| Aprendemos
na biologia que cada espécie de ser vivo ou inanimado pertence a uma
certa classificação, e dentro de cada espécie, os indivíduos são
classificados conforme algumas características. Por exemplo, os seres
humanos podem ser classificados pelo gênero (masculinos / feminino),
pela cor da pele, pela altura, pelo peso, pela idade, etc. No mundo atômico, os indivíduos são os átomos, ou elementos químicos, e eles também podem ser classificados de acordo com suas propriedades atômicas. Muitos átomos são semelhantes a outros em relação a algumas propriedades, mas não há um átomo com todas as propriedades idênticas às de outro átomo diferente. Ou seja, cada átomo é um indivíduo único. Existem diferentes tipos de classificações, dependendo da área de atuação profissional de quem propôs. À direita tem um tipo de classificação, e abaixo tem outra. Em seguida falaremos mais sobre isso. Nesse momento é importante chamar a atenção para o fato de que a comunidade científica aceita a classificação que é exibida na tabela periódica, como você verá na página dedicada a esse assunto. |
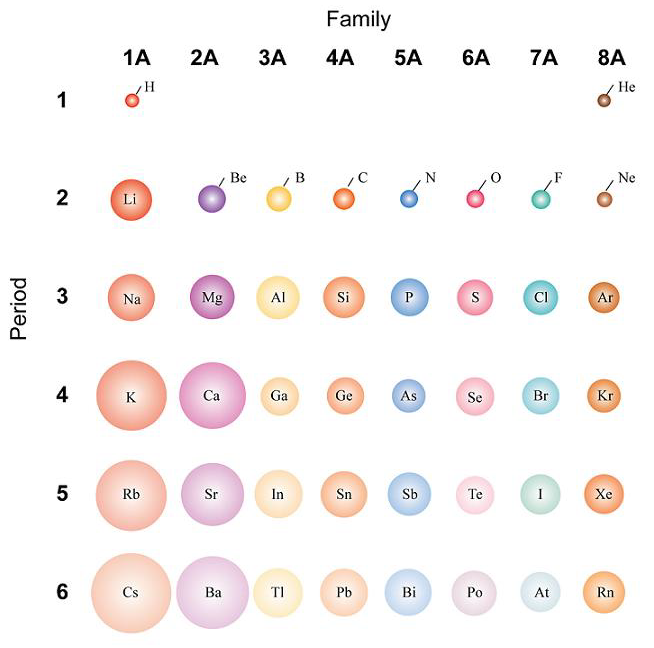 Essa figura é uma parte da tabela periódica. Nessa classificação, as linhas horizontais definem os períodos, enquanto as verticais definem as famílias ou grupos.
Entre os grupos ou famílias e os períodos, existem outras subclassificações, mais específicas, como ilusta a figura abaixo. |
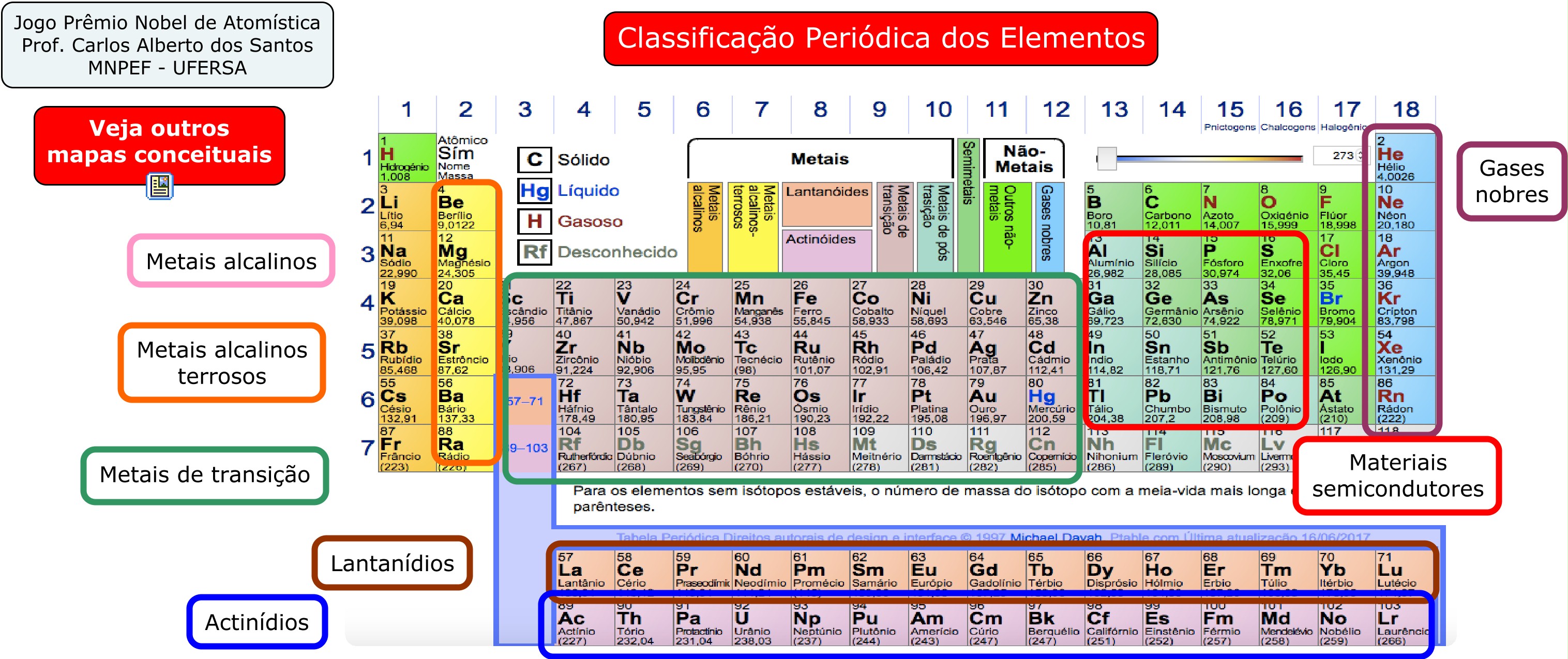 |
As características usadas para classificar os átomos são conhecidas como propriedades atômicas. Na página sobre a tabela periódica
você vai aprender porque os átomos com propriedades atômicas similares
ocupam lugares próximos nessa tabela, e porque essas propriedades
apresentam características periódicas. Aqui nesta página vamos tratar
apenas de definir essas propriedades:
|
| NÚMERO ATÔMICO, NÚMERO DE MASSA E PESO ATÔMICO |
| O
número atômico, representado pela letra Z, é a propriedade mais
importante de um átomo. Poderíamos até mesmo substituir o nome do
elemento químico pelo seu número atômico. Em vez de dizer carbono, poderíamos simplesmente dizer o elemento químico número 6,
ou o átomo 6. É claro que essa é uma ideia boba. É muito mais
fácil fixar um elemento químico pelo seu nome do que por um número. A
ideia só serve para reforçar o fato de que o número atômico funciona
como se fosse o nome do átomo. O número atômico indica a quantidade de prótons existente no núcleo do átomo. O número atômico do carbono é 6 porque ele tem 6 prótons no núcleo. O núcleo é constituído por prótons e nêutrons. A soma de prótons e nêutrons é o número de massa do núcleo. O peso atômico é definido |
| RAIO NUCLEAR E RAIO ATÔMICO |
O raio nuclear é medido na escala do femtômetro (fm). Aproximadamente 0,8 fm para o hidrogênio e 7,5 fm para átomos pesados, como urânio. Procure na internet a relação entre femtômetro e metro. Resultados experimentais mostraram que o raio nuclear depende do número de massa, A, de acordo com a fórmula
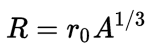
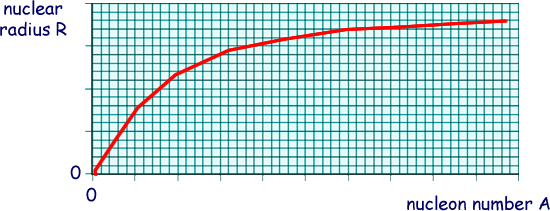
A constante r0 é aproximadamente igual a 1,25 fm. À medida que cresce o valor de A, o raio nuclear tende para um valor constante. Tecnicamente se diz que a curva de R em função de A satura para grandes valores de A, como ilustra a figura abaixo.
Ao contrário do raio nuclear, que varia continuamente em função do número de massa, o raio atômico apresenta uma periodicidade. Ou seja, ele diminui dentro de um período, volta a crescer no início do período seguinte, para novamente voltar a diminuir, como ilustra figura abaixo. Na página sobre a tabela periódica discutiremos porque isso é assim. Por enquanto é suficiente ter em mente essa periodicidade, e que o raio atômico no início de um período é menor do que no final.
| ELÉTRONS DE VALÊNCIA |
| Nas páginas sobre o modelo de Rutherford-Bohr e sobre a tabela periódica,
discutimos os níveis ou camadas atômicas K, L, M, N, etc. Vamos
aprofundar essa discussão para chegarmos aos elétrons de valência. As órbitas ou níveis n=1,2,3, etc., do modelo de Bohr, foram substituídas pelas camadas K, L, M, N, etc. Mas, logo depois se percebeu que para distribuir os elétrons em cada átomo, seria necessário dividir as camadas em termos espectroscópicos, s, p, d, f, e dividir e esses termos em orbitais. Eu sei, tudo isso é muito complicado, e a explicação detalhada só pode ser dada com a teoria quântica, mas podemos esquematizar essa história para ela ficar mais compreensível.
Agora vamos fazer uns cálculos simples. Cada camada K, L, M, N, comporta, respectivamente, 2, 8, 18 e 32 elétrons. Dividindo esses números por 2, teremos o número de orbitais em cada camada. Ou seja:
Então:
Sabendo quantos orbitais cada termo contém, é fácil saber quantos elétrons eles podem conter. Basta multiplicar o número de orbitais por 2. Ou seja:
Na linguagem científica, os resultados acima referem-se às configurações eletrônicas das camadas K, L, M e N, e são simbolicamente assim representadas: 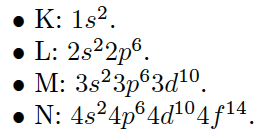 Eu sei que é óbvio, mas não custa repetir: o número que aparece antes da letra refere-se ao nível n no modelo de Bohr (K=1, L=2, M=3, N=4). O expoente da letra é o número máximo de elétrons no termo espectroscópico. |
| Agora
temos conhecimento suficiente para discutir os elétrons
de valência. Para isso, convém separar os elementos químicos em dois
grandes
grupos. Um deles constituído pelos elementos de transição, e outro
constituído pelo restante dos elementos químicos. Os elementos de
transição pertencem aos grupos 3
até o 12, e apresentam alguns comportamentos muito diferentes dos
outros elementos. Na página sobre a tabela periódica
essas propriedades são discutidas. Para o momento basta saber que para
discutir os elétrons de valência, temos que colocar os elementos de
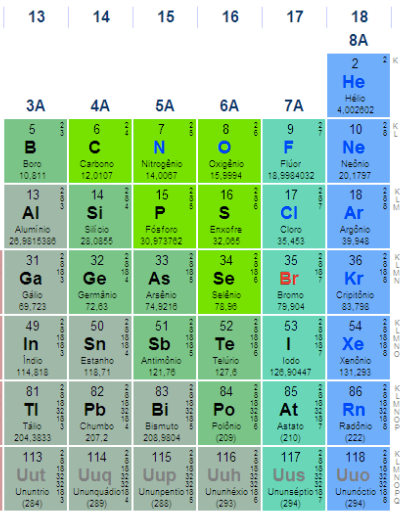
transição separados dos outros. Observe na figura abaixo que em outra
forma de indicar os grupos, os elementos de transição são classificados
com a letra B, enquanto todos os outros elementos são classificados com
a letra A. Isso caracteriza a diferença de comportamento entre esses
dois grandes grupos. Pela sua complexidade, não vamos considerar aqui os elétrons de valência dos elementos de transição. |
 |
 |
 |
| Os elétrons de valência são aqueles que participam nas reações químicas para formação dos compostos. No caso dos elementos dos grupos 1 e 2 (1A e 2A) e dos grupos 13 até o 18 (3A até 8A), esses elétrons ficam na última camada. Então, os números de elétrons de valência desses grupo são:
Agora, veja se isto não é lógico: Átomos
com um ou dois elétrons na última camada, por exemplo o lítio e
berílio, são altamente reativos porque facilmente eles cedem esses
elétrons nas reações químicas.
A mesma coisa vale para átomos com a última camada quase completa ou com o octeto quase formado, faltando um ou dois elétrons, por exemplo oxigênio e flúor. Eles são altamente reativos porque facilmente recebem elétrons nas reações químicas. Em ambos os casos, o mecanismo de ceder ou receber elétron tem o mesmo resultado: deixar a última camada completa ou com o octeto formado. |
| ELETRONEGATIVIDADE, ELETROPOSITIVIDADE E AFINIDADE ELETRÔNICA |
|
Esses três conceitos têm a ver com o mesmo processo, ou seja, com a
transferência de elétrons de um átomo para outro, mas o único que pode
ser medido para um átomo é a afinidade eletrônica.
Tanto a eletronegatividade, quanto a eletropositivade são propriedades
de um átomo como constituinte de uma molécula, e não podem ser medidos,
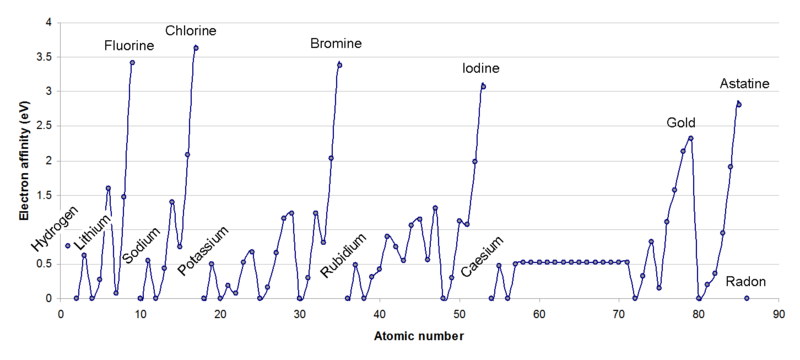
apenas calculados com bases em alguns modelos moleculares. De uma maneira geral podemos definir: Afinidade
eletrônica é a quantidade de energia liberada por um átomo neutro quando ele ganha um elétron e torna-se um íon negativo.
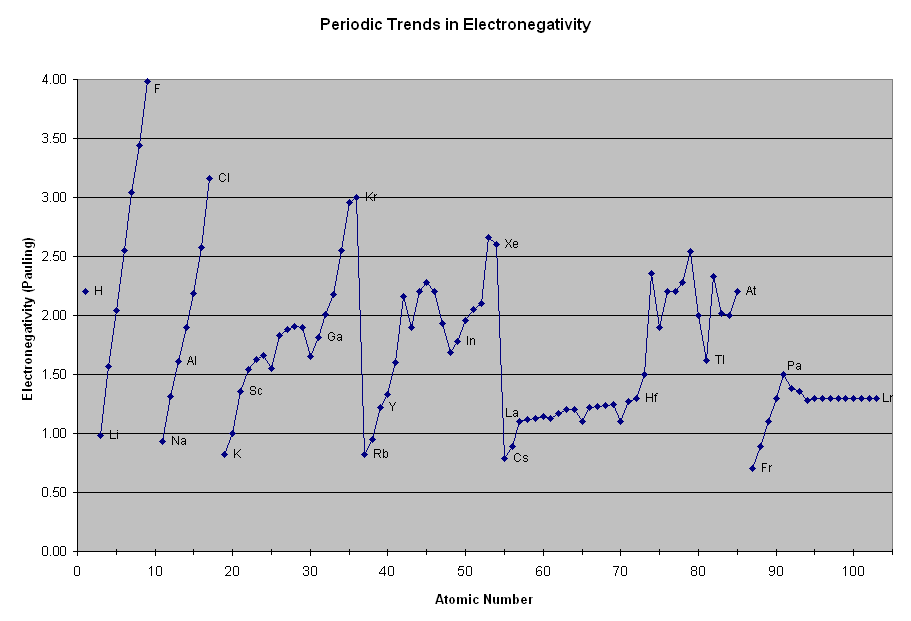
Eletronegatividade é a tendência de um átomo em atrair elétrons nas reações químicas.
Eletropositividade
é o contrário da eletronegatividade, ou seja, é a tendência do átomo em
liberar elétrons nas reações químicas. Quando um átomo libera um elétron, ele é denominado íon positivo.
À esquerda, na figura abaixo, a afinidade eletrônica, e à direita, a eletronegatividade. Observe que embora uma propriedade seja referente ao átomo isolado e a outra refira-se ao átomo como constituinte de uma molécula, ambas apresentam o mesmo tipo de tendência ao longo da tabela periódica. Vamos explicar esses resultados. O lítio tem 1 elétron na camada L, enquanto o flúor tem 7. Portanto, é muito mais fácil para o flúor receber 1 elétron para completar o octeto, do que o lítio receber 7. Portanto, o flúor é mais eletronegativo do que o lítio. Por outro lado, é muito mais fácil o lítio perder seu único elétron na última camada, do que o flúor perder os seus. Sendo assim, o lítio é mais eletropositivo. O mesmo argumento pode ser usado para os outros períodos. |
 |
 |
| ENERGIA DE IONIZAÇÃO |
| Energia
de ionização é uma das propriedades mais importantes dos átomos.
Praticamente em todos os processos atômicos tem-se o envolvimento da
energia de ionização, que é a energia necessária para liberar um ou
mais elétrons de um átomo, deixando-o com carga positiva. Em seguida
esse átomo ionizado recupera os elétrons perdidos, geralmente por meio
de reações químicas. Lembra
o modelo de Bohr? Cada órbita na qual o elétron gira em torno do
núcleo define a energia do elétron. Nas órbitas mais próximas ao
núcleo, a energia de ligação do elétron ao núcleo é maior do que nas
órbitras mais afastadas. Portanto, é mais fácil extrair um elétron de
uma camada mais afastada do que de uma camada mais próxima ao núcleo.
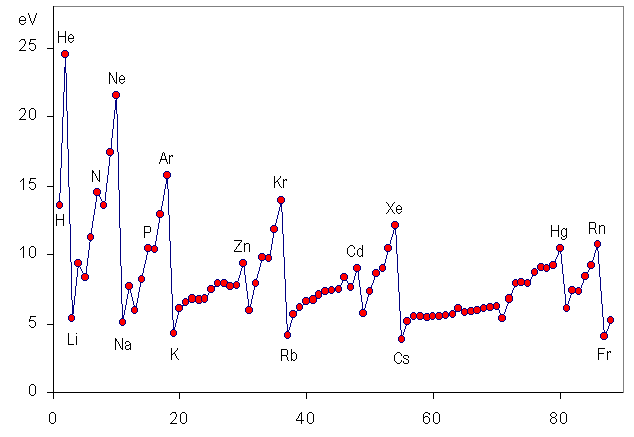
Então, a menor energia necessária para ionizar um átomo é aquela que
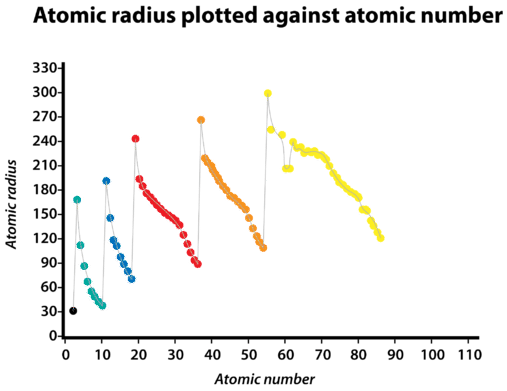
libera o elétron da última camada. Essa energia é denominada PRIMEIRA ENERGIA DE IONIZAÇÃO, cujos valores são apresentados na figura abaixo para os primeiros 88 elementos da tabela periódica.
|
 |