Classificação Periódica dos Elementos
Este material é parte integrante do Jogo do Prêmio Nobel de Atomística
© Carlos Alberto dos Santos, Eliabe Maxsuel de Aquino, Farnésio Vieira Diniz
© Carlos Alberto dos Santos, Eliabe Maxsuel de Aquino, Farnésio Vieira Diniz
| Vou repetir aqui parte da introdução que apresentei na página sobre as propriedades atômicas, porque o texto também vale para introduzir a classificação periódica dos elementos, como expressa na tabela periódica. Aprendemos na biologia que cada espécie de ser vivo ou inanimado pertence a uma certa classificação, e dentro de cada espécie, os indivíduos são classificados conforme algumas características. Por exemplo, os seres humanos podem ser classificados pelo gênero (masculinos / feminino), pela cor da pele, pela altura, pelo peso, pela idade, etc. No mundo atômico, os indivíduos são os átomos, ou elementos químicos, e eles também podem ser classificados de acordo com suas propriedades atômicas. Muitos átomos são semelhantes a outros em relação a algumas propriedades, mas não há um átomo com todas as propriedades idênticas às de outro átomo diferente. Ou seja, cada átomo é um indivíduo único. Existem diferentes tipos de classificações, dependendo da área de atuação profissional de quem propôs, mas todas as classificações estão presentes na tabela periódica, do que nos ocuparemos nessa página. |
| A
tabela periódica como hoje a conhecemos, essa que é publicada em todos
os livos didáticos, surgiu em 1913. Antes, era a tabela inventada por
Dimitri Ivanovich Mendeleiev (1834-1907), por volta de 1869. Naquela
época os elementos químicos costumavam ser agrupados de duas maneiras:
pelo peso atômico ou por propriedades comuns (se eram metais ou gases,
por exemplo). A grande revolução de Mendeleiev foi perceber que as duas
podiam ser combinadas em uma tabela única. |
 |
 NÚMERO ATÔMICO
E PESO ATÔMICO Na época de Mendeleiev, ainda não existia o elétron, o próton, nem o átomo de Bohr. Tudo isso surgiu na virada do século 19 para o século 20. Para Mendeleiev, o número atômico era aproximadamente igual à metade do peso atômico. Em 1913, Henry Moseley (1887-1915) definiu o número atômico como igual ao número de elétrons do átomo eletricamente neutro. |
À esquerda, manuscrito de Mendeleiev com a sua tabela periódica.
Abaixo, versão impressa em russo da mesma tabela. Ela continha apenas cinco colunas. Mendeleiev inspirou-se no jogo de cartas paciência, para distribuir os elementos químicos nessas cinco colunas. Na horizontal os elementos são distribuídos pela similaridade de propriedades químicas, e na vertical na ordem crescente dos pesos atômicos.  |
| Em
1913, a partir de espectros de raios-X de vários elementos químicos,
Moseley mostrou que a ordenação dos elementos deveria ser em função do
número atômico, e não em função do peso atômico, como fazia Mendeleiev.
Ordenando os elementos em função dos números atômicos, ele mostrou que
a tabela periódica de Mendeleiev deveria ser modificada. Vários
elementos deveriam trocar de lugar, e alguns lugares estavam vagos. Nos
anos seguintes esses lugares foram preenchidos com a descoberta de
outros elementos químicos. Se você quiser uma leitura mais detalhada,
leia esse texto: Os Raios X e a Tabela Periódica: A Lei de Moseley. A partir desses estudos, Moseley propôs a tabela periódica utilizada até o presente. Existem inúmeras tabelas na internet, cada uma apresentando diferentes informações sobre os átomos. Selecionei alguns exemplos interessantes, em português e em inglês: Examine atentamente essa tabela periódica: 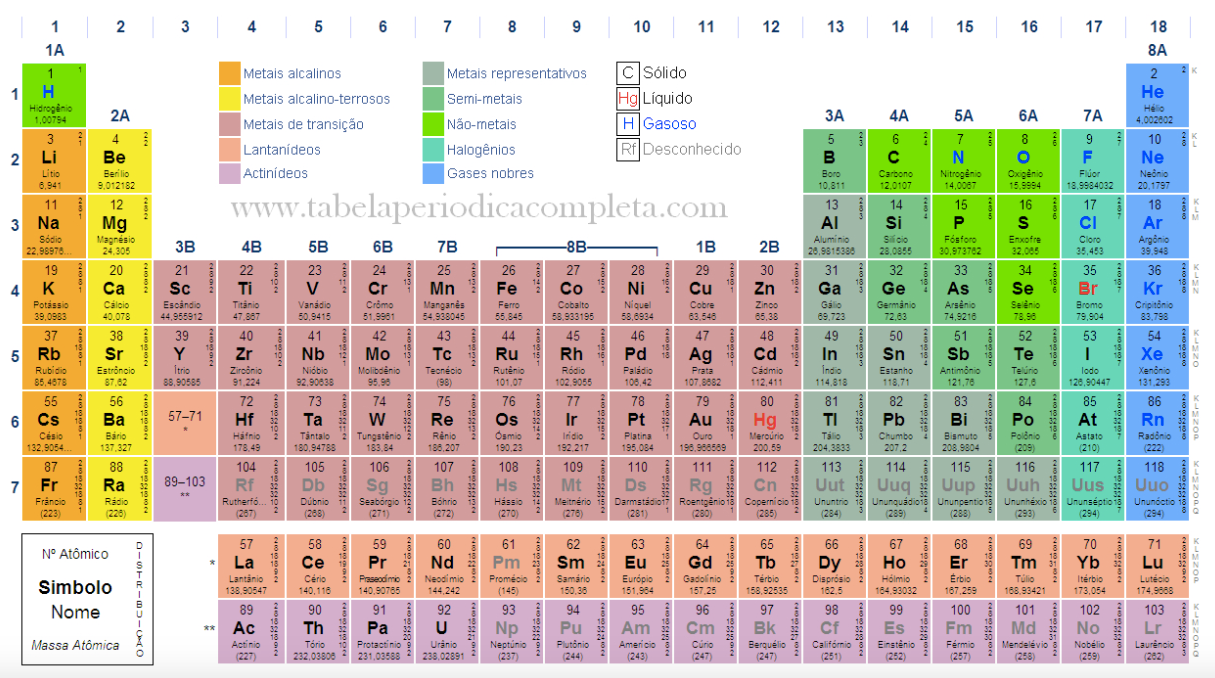 Observe que os elementos são marcados com cores diferentes. Cada cor define algum tipo de propriedade química. Mais adiante voltaremos a discutir isso. Primeiramente observe que existem 18 colunas e 7 linhas horizontais. As linhas definem os períodos, enquanto as colunas definem as famílias ou grupos. Os elementos químicos são distribuídos na horizontal na ordem crescente do número atômico, ou seja, o átomo seguinte na horizontal tem um elétron a mais do que o anterior. Dito de outro modo, na horizontal os átomos são formados pelo acréscimo de um próton e um elétron, e evidentemente de alguns nêutrons. Uma
questão super importante, que raramente é discutida nos livros
didáticos: por que a tabela periódica tem exatamente 18 colunas?
|
| Para responder a essa questão e discutir outras características da tabela periódica precisamos levar em conta o modelo de Rutherford-Bohr.
Na discussão do modelo, associamos cada nível de energia, ou órbita
permitida para o elétron, a um número inteiro, 1, 2, 3, etc. Logo
depois da sua proposta, Bohr e outros físicos passaram a denominar
esses níveis pelas letras K, L, M, N, correspondendo respectivamente a
1, 2, 3 e 4. Também
em vez de nível, essas órbitas passaram a ser denominadas camadas.
Então, os átomos têm elétrons na camada K, na camada L, etc.
Pela teoria quântica, que surgiu logo após o modelo de Bohr, cada uma
dessas camadas só pode acomodar um certo número máximo de elétrons.
Veja esses números na coluna à direita. |
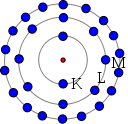 Camada K
fica cheia com 2 elétrons;
Camada L com 8; Camada M com 18; Camada N com 32. |
| Para
entendermos a distribuição dos elementos químicos na tabela periódica
precisamos saber mais uma coisa. Raramente os produtos químicos contêm
apenas um elemento. Geralmente eles são compostos de dois ou mais
elementos. |
|
COMO OS ELEMENTOS QUÍMICOS SE JUNTAM PARA FORMAR COMPOSTOS?
Não há uma resposta
simples e rápida a essa questão. Existem muitos aspectos a serem
considerados. Na verdade, a resposta completa só depois de todo o curso
de química. Mas, para entendermos os princípios da tabela periódica
basta sabermos que toda
reação para a formação de qualquer composto químico depende, de um modo
ou de outro, da transferência de elétrons de um átomo para outro. Para
que um átomo receba elétron durante a reação, ele deve ter espaço livre
na última camada, ou ter uma quantidade diferente de 8 elétrons nessa
camada. Essa quantidade está ligada à famosa regra do octeto.REGRA DO OCTETO
Quando
são formadas ligações entre átomos, esses átomos tendem a partilhar
elétrons para completar seus octetos e ficarem semelhantes aos gases
nobres. Ou seja, se a última camada já tiver 8 elétrons, o átomo será
quimicamente inerte, ou dificilmente formará compostos com outros
átomos.Vamos examinar tudo isso na prática. Fique de olho na tabela periódica. O hidrogênio tem um elétron na camada K. Portanto ele pode receber mais um elétron, ou então compartilhar o seu com outro átomo para formar compostos. O átomo seguinte é o hélio, que tem dois elétrons na camada K. Portanto, a camada K do hélio está cheia. Ele não pode receber outro elétron e não pode formar compostos. É por isso que ele é conhecido como gás inerte, ou gás nobre. Na verdade, há casos excepcionais em que os gases nobres formam compostos, mas essas exceções não importam aqui. O período seguinte, ou seja, o período 2, começa com o lítio, que tem três elétrons. Dois na camada K e um na camada L. Então, ele tem espaço livre na camada L para receber elétrons ou compartilhar seu elétron com outros elementos e formar compostos. Os átomos seguintes, ao longo da linha horizontal serão formados pelo acréscimo de um elétron na camada L, até atingir 8 elétrons, formando o octeto. Portanto, esse átomo com 8 elétrons na camada L deve ser inerte. Trata-se do gás nobre neônio. Se você observar bem a tabela periódica, vai perceber que a regra básica para todos os períodos é essa: inicia com um átomo possuindo 1 elétron na última camada e termina com um gás nobre, possuindo 8 elétrons naquela camada que iniciou o período. Esse processo obedece à regra do octeto, MAS . . . TEM UMA COISINHA DIFERENTE NESSA HISTÓRIA
Observe o período 4. Ele começa com o potássio, que tem 19 elétrons. As camadas K e L estão cheias, totalizando 10 elétrons. Pelo que aprendemos até agora, o potássio deveria ter 9 elétrons na camada M, uma vez que esta camada só fica completa com 18 elétrons. No entanto, o potássio tem 8 elétrons na camada M e 1 elétron na camada N. Então, o que acontecerá com o próximo átomo, o cálcio? O próximo elétron vai para a camada M ou para a N? As duas camadas têm espaço para esse elétron, mas a natureza resolveu colocar o último elétron do cálcio na camada N. Por quê? Uma
resposta mais precisa só pode ser dada com conceitos da teoria
quântica, mas podemos ter uma ideia intuitiva de parte do processo. Por
exemplo, o elétron não vai para a camada M porque ela completou seu
primeiro octeto. Com 8 elétrons, essa camada é estável do ponto de
vista de reação química. Ela é similar à estrutura dos gases nobres.
Então, o elétron vai para a camada N. Agora, o que vai acontecer em
seguida é mais misterioso ainda e só pode ser mesmo explicado com a
ajuda da teoria quântica.
COMO PREENCHER AS CAMADAS ELETRÔNICAS A PARTIR DO CÁLCIO?
Temos duas alternativas. A primeira seria acrescentar elétrons na camada M até atingir seu limite de 18 elétrons. Essa alternativa é contrária à regra do octeto, de modo que a natureza não deve dar-lhe prioridade. A outra alternativa seria preencher a camada N até atingir o primeiro octeto. No momento que as camadas M e N estiverem com o primeiro octeto formado, teria que haver algum critério para decidir onde colocar o próximo elétron. TODAVIA . . . A NATUREZA NÃO SEGUE NENHUMA DESSAS ALTERNATIVAS
O preenchimento do cálcio segue a segunda alternativa. Ele fica com 8 elétrons na camada M e 2 na N. Mas, entre o escândio, Z=21 e o zinco, Z=30, não há lógica aparente no preenchimento das camadas eletrônicas. Como foi dito acima, essa lógica é apresentada pela teoria quântica. Então, temos que aceitar esse resultado sem uma explicação lógica dentro do que conhecemos. A mesma sistemática é observada nos períodos seguintes. Os
elementos químicos pertencentes aos grupos 3 até o 12, que apresentam a
sistemática de preenchimento descrita acima, são denominados elementos de transição.
Então, excetuando as anomalias apresentadas pelos elementos de transição no preenchimento das camadas eletrônicas, podemos dizer que no geral que cada período é caracterizado pelo preenchimento progressivo de determinada camada: Período 1: preencimento da camada K;
Período 2: preencimento da camada L; Período 3: preencimento da camada M; Período 4: preencimento da camada N; Período 5: preencimento da camada O; Período 6: preencimento da camada P; Período 7: preencimento da camada Q. Os elementos que iniciam os períodos estão entre os mais reativos. A razão é simples. Eles têm apenas um elétron na última camada, de modo que é fácil para eles receberem elétrons de outro átomo ou doarem seu elétron para formarem compostos químicos. |
|
COMO AS PROPRIEDADES ATÔMICAS VARIAM AO LONGO DA TABELA PERIÓDICA?
As propriedades atômicas foram discutidas em outra página. Uma coisa impressionante é que algumas dessas propriedades variam periodicamente, em sintonia com os períodos e grupos da tabela periódica. Vamos ver agora a variação de algumas dessas propriedades. |
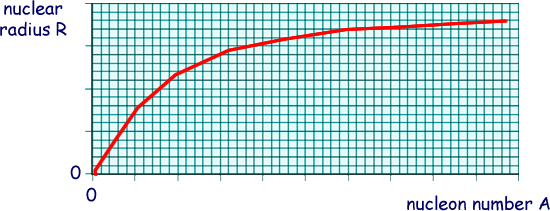 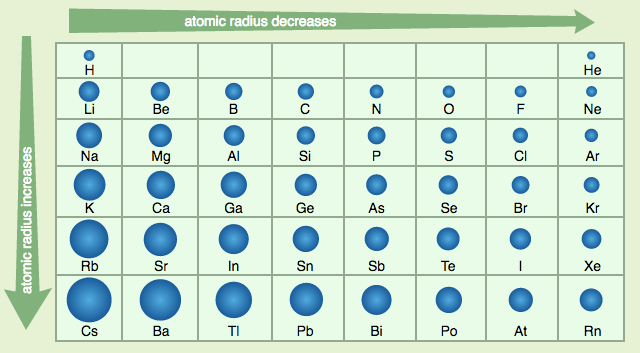 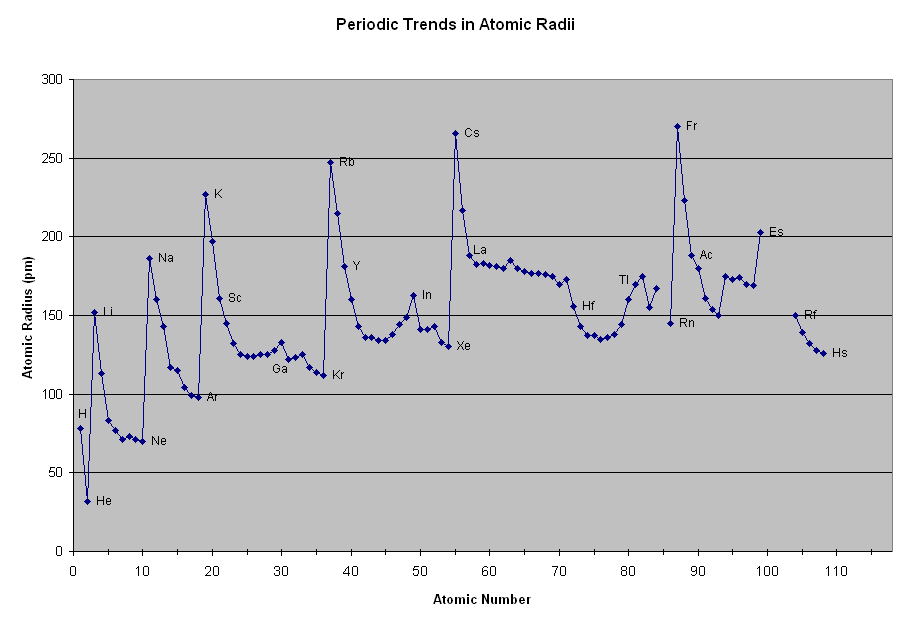 |
Raio atômico e raio nuclear
O raio nuclear cresce com o número de massa, A, que é a soma do número de prótons e nêutrons, do modo como ilustra a figura de cima na coluna à esquerda. O crescimento é quase linear para os átomos leves, e depois tende para um valor constante nos átomos pesados. Por outro lado, a variação do raio atômico depende do período da tabela periódica. Ele aumenta de cima para baixo e diminui da esquerda para a direita, como ilustra a figura do meio na coluna à esquerda. Para entender por que isso é assim, basta analisar um período. O comportamento é basicamente o mesmo em todos os períodos. |
| Vamos
analisar o período 2, que começa com o lítio e termina com o neônio.
Observe o gráfico acima. O raio atômico do lítio é aproximadamente 150
picômetros (procure na internet qual a relação entre metro e picômetro), ao passo que o do neônio é algo próximo a 75 pm (picômetro), quase a metade do raio do lítio. Se o neônio tem 7 prótons e 7 elétrons mais do que o lítio, por que ele é menor?
Em primeiro lugar, todos os elétrons acrescentados ao lítio e aos sucessivos átomos até chegar ao neônio, são colocados nas mesma camada L, de modo que eles pouco alteram o raio atômico desses átomos. Por outro lado, os prótons acrescentados aumentam a energia de ligação dos elétrons e como consequência diminuem os raios das órbitas. Os elétrons ficam mais próximos do núcleo e, portanto, o raio atômico é menor. Por que o raio atômico cresce de cima para baixo na tabela periódica?
Neste caso, os elétrons acrescentados são colocados em órbitas cada vez mais afastadas do núcleo. Por exemplo, acabamos de ver que no lítio os elétrons mais afastados ficam na camada L. No potássio, esses elétrons ficam na camada N, que tem um raio muito maior do que a L. Portanto, o raio atômico do portássio é maior do que o do lítio. |
|
Raios atômicos de todos os átomos: http://periodictable.com/Properties/A/AtomicRadius.v.html
|
|
Eletronegatividade e Afinidade Eletrônica
Na página sobre propriedades atômicas, vimos que a eletronegatividade é a tendência do átomo atrair elétrons em uma reação quimica, ao passo que afinidade eletrônica é a energia liberada por um átomo neutro quando ele ganha um elétron e torna-se um íon negativo. Portanto, são duas propriedades que têm o mesmo comportamento, como ilustram as figuras ao lado. A diferença é que apenas a afinidade eletrônica pode ser medida, enquanto a eletronegatividade só pode ser calculada. |
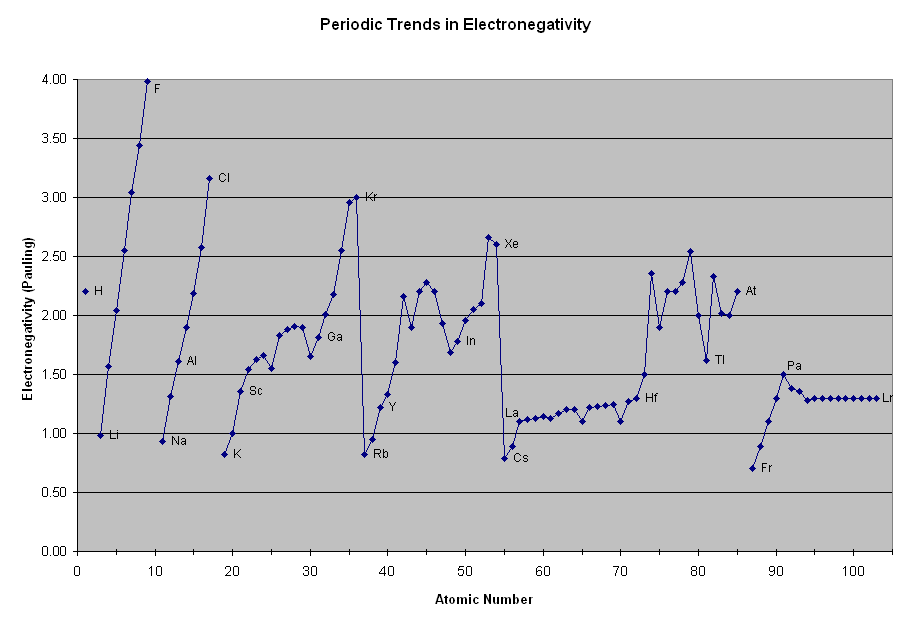 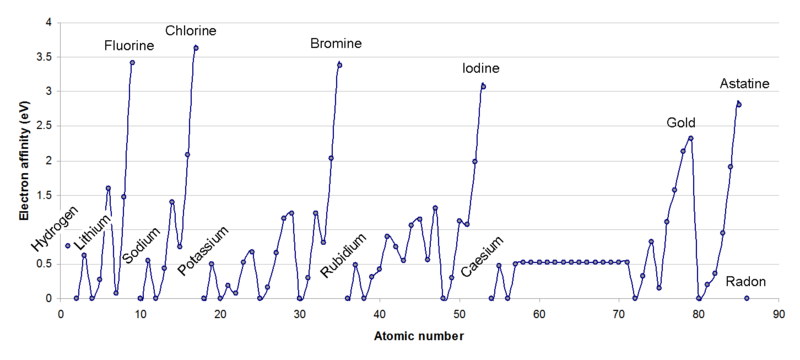 |
Energia de ionização
Energia de ionização é a energia necessária para liberar um ou mais elétrons de um átomo, deixando-o positivamente carregado. Ou seja, o átomo neutro passa a ser um íon positivo. A figura à direita mostra a primeira energia de ionização dos primeiros 88 elementos químicos. Para entender esse comportamento períodico da energia de ionização, temos que levar em conta o comportamento do raio atômico. Para simplificar a discussão vamos considerar apenas o último elétron, cuja energia de ionização é exatamente essa denominada primeira energia de ionização. A energia de ionização é a energia necessária para vencer a energia de ligação do elétron ao núcleo. Essa energia de ligação depende de duas coisas: da carga efetiva do núcleo, e da distância do elétron ao núcleo. À medida que cresce o número atômico, Z, cresce a carga positiva no núcleo, mas também cresce a carga negativa à sua volta. |
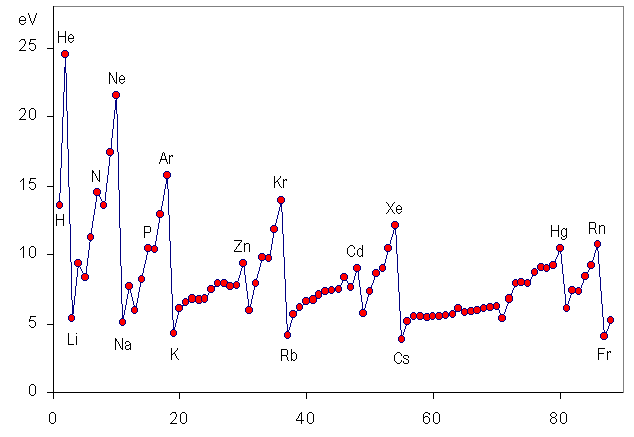
Para os elétrons mais externos, essa carga negativa funciona como uma
blindagem da carga nuclear, tornando a carga efetiva do núcleo menor do
que a carga do total de prótons.
Conforme discutimos na página sobre as propriedades atômicas, dentro de cada período da tabela periódica combinando atração elétrica entre núcleo e elétrons, resulta que à medida que o número atômico cresce, diminui o raio atômico. Portanto, aumenta a energia de ligação e consequentemente aumenta a energia de ionização, como mostrado na figura acima. |