Modelos atômicos
Este material é parte integrante do Jogo do Prêmio Nobel de Atomística
© Carlos Alberto dos Santos, Eliabe Maxsuel de Aquino, Farnésio Vieira Diniz
© Carlos Alberto dos Santos, Eliabe Maxsuel de Aquino, Farnésio Vieira Diniz
| Os
modelos atômicos considerados modernos são os modelos de Thomson e de
Rutherford-Bohr. Passaram-se séculos entre os modelos da antiguidade e
o modelo de Dalton, e um século entre este e os modelos modernos. Os modelos de Thomson, Rutherford e Bohr são consequências das descobertas que se seguiram aos estudos dos raios catódicos. Para leituras mais aprofundadas sobre o assunto, visite esses endereços:
|
 |
 Joseph John Thomson (1856-1940) |
Por volta de 1890,
qualquer laboratório de física importante na Europa investigava os
raios catódicos. Em novembro de 1895, quando estudava esses raios,
Roentgen descobriu os raios-X.
A descoberta foi tão impactante, que quase toda a comunidade de físicos
passou a estudar e repetir os experimentos de Roentgen. E foi assim que
Thomson descobriu o elétron, em 1897, com esse equipamento, cuja descrição não cabe aqui. |
 |
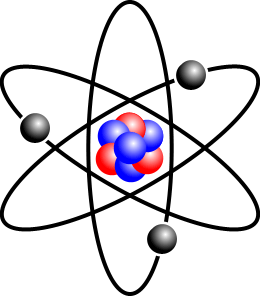
Logo
depois dessa descoberta, precisamente em março de 1904, Thomson propôs
seu modelo atômico, também conhecido como Modelo do Pudim de Ameixa.
Para Thomson, havia três possibilidades para a constituição do átomo,
que deveria ser eletricamente neutro:
Thomson escolheu a terceira alternativa como a mais provável, e é por isso que seu modelo é conhecido como Pudim de Ameixa. As cargas positivas formariam o pudim, e os elétrons seriam as ameixas. |
 |
Por volta de 1908, Rutherford e seus colaboradores, sobretudo Geiger e Marsden passaram a realizar
experimentos com espalhamento de partículas alfa, que Rutherford havia
identificado como sendo igual ao núcleo de hélio. Essa história você
poderá conhecer lendo esse texto sobre a radioatividade.
Não precisamos conhecer os detalhes desses experimentos. Basta saber
que os resultados foram surpreendentes. Eles jogaram jatos de
partículas alfa sobre uma finíssima folha de ouro. Esperavam que o
feixe sofresse uma pequeno espalhamento, devido ao choque das
partículas com os átomos de ouro. Mas, observaram que algumas
partículas, menos de 1% do total sofriam grandes desvios, como ilustram
as figuras abaixo. |
 |
 |
| Hans
Geiger (1882-1945), à esquerda, e Ernest Rutherford (1871-1937) com o
equipamento utilizado nos experimentos de espalhamento alfa. O outro
colaborador de Rutherford nesses experimentos foi Ernest Marsden
(1889-1970). |
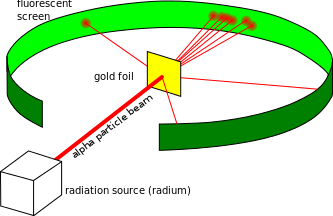
Esquema
do experimento de espalhamento alfa. Mais de 99% das partículas
atravessam a folha de ouro praticamente sem desvio. Menos de 1% sofre
grandes desvios. As partículas são registradas numa tela fluorescente. |
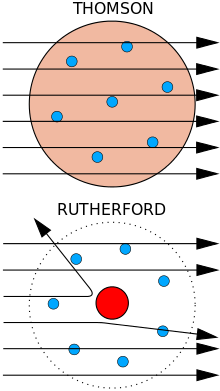
| se
o átomo fosse como previsto no modelo de Thomson, ou seja, se as cargas
positivas e negativas fossem distribuídas uniformemente, as partículas
alfa não sofreriam grandes desvios. Para resolver o mistério dos
grandes desvios, Rutherford adotou a segunda hipótese de Thomson,
segunda a qual o átomo é constituído de uma pequena região, chamada
núcleo, com partículas positivas e muito pesadas, em comparação ao peso
do elétron. Nesse modelo, a massa do átomo concentra-se praticamente no
núcleo. Hoje sabemos que o núcleo contém prótons e nêutrons, com massas
similares e aproximadamente 1800 vezes maiores do que a massa do
elétron, mas o próton só foi descoberto, por
Rutherford, em 1919, e o nêutron foi descoberto por James Chadwick
(1891-1974), um dos colaboradores de Rutherford, em 1932. |
 |

|
Em
março de 1912, Niels Bohr (1885-1962) chega a Manchester para fazer um
estágio de pós-doutorado com Rutherford e logo começa a analisar os
resultados obtidos com o espalhamento alfa, partindo do modelo proposto
por Rutherford. Detalhes sobre essa história você pode ler nesse
endereço: https://www.if.ufrgs.br/tex/fis142/fismod/mod06/m_s04.html. Veremos aqui apenas os fatos mais importantes. A primeira coisa importante no modelo de Rutherford é uma decepção. Pela teoria clássica do eletromagnetismo, uma carga negativa orbitando em volta de uma carga positiva não poderia ficar nessa situação por muito tempo. Ela perderia energia e terminaria se juntando à carga positiva. Essa perda de energia resulta do fato de que qualquer carga elétrica acelerada irradia energia eletromagética. E o elétron girando em volta do núcleo é uma carga acelerada. Portanto, perderá energia resultando no colapso do núcleo. Se assim fosse, a matéria não existiria. Para resolver essa dificuldade, Bohr propôs o que para alguns é denominado Modelo de Bohr, e para outros trata-se do Modelo de Ruhterford e Bohr, ou simplesmente Modelo de Rutherford-Bohr. |
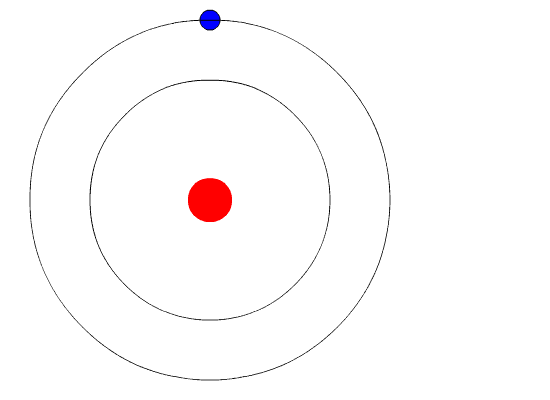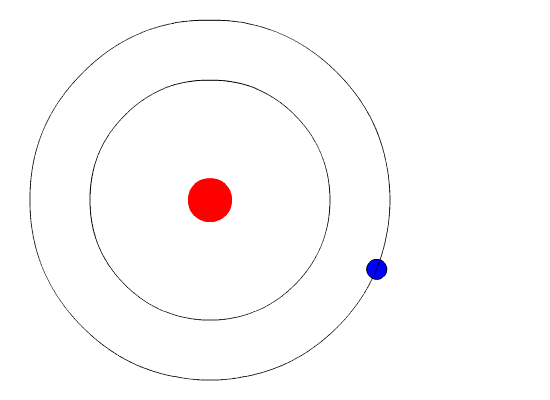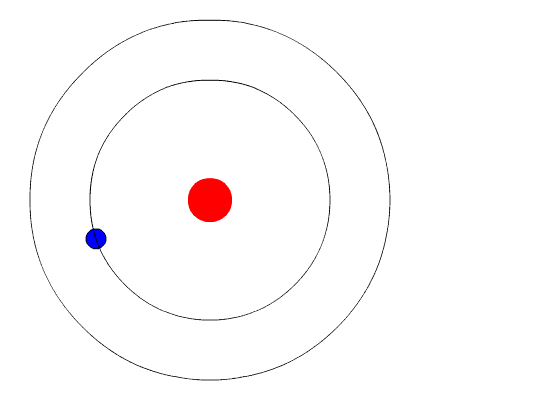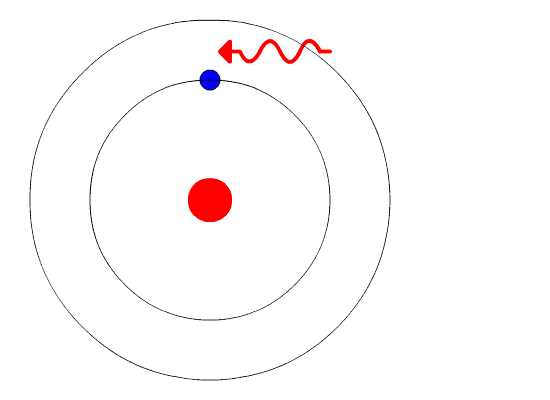
| Bohr
teve a coragem de desafiar a física clássica, postulando determinados
comportamentos atômicos não previstos até então. Postulado é uma
afirmação que se faz sem necessidade de demonstração. Algo do tipo:
isso é assim porque é. Não precisa demonstrar que é verdade. Então, Bohr começou postulando que em determinadas circunstãncias o elétron pode estar acelerado e assim mesmo não emitir radiação eletromagnética. A circunstãncia em que isso ocorre ele chamou de estado estacionário do átomo, no qual o elétron gira em órbita indefinidamente. Bohr também postulou que cada átomo tem várias órbitas estacionárias. Um elétron só sai de uma órbita estacionária em duas ocasiões. A primeira é quando ele recebe energia do exterior. Neste caso ele pode saltar para uma órbita mais afastada do núcleo. A segunda é quando ele espontaneamente salta para uma órbita mais próxima do núcleo. Neste caso, ele emite energia. A figura ao lado ilustra as duas situações. O elétron recebe energia por meio de uma radiação externa. Dependendo do átomo, essa radiação pode ser luz visível, ultravioeta ou raios-X, entre outras. Com esses e outros postulados, que não precisam ser discutidos aqui, Bohr mostrou que cada órbita tem uma energia bem determinada, e que o salto de uma órbita para outra envolve a recepção ou emissão de energia igual à diferença de energia das duas órbitas. Veja os cálculos do Modelo de Rutherford-Bohr. |
 |